Еще в 1885 г. швейцарский физик И. Бальмер нашел определенную закономерность в расположении спектральных линий водорода и показал, что длины волн, соответствующие линиям видимой части спектра, могут быть вычислены по формуле, которую теперь записывают в виде
1/λ = R (1/22 – 1/m2) (35.8)
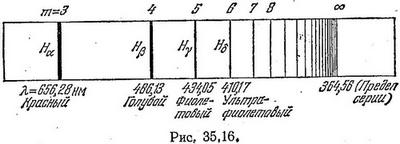
Здесь каждому целому числу m, большему двух, соответствует спектральная линия, а R носит название постоянной Ридберга: R = 10967758 м-1. Все линии спектра водорода, определяемые формулой (35.8), составляют серию Бальмера, изображенную на рис. 35.16 (длины волн приведены в нм).
Позднее в спектре водорода были найдены еще и другие серии линий, получающиеся при замене двойки в (35.8) на целое число n, и формула получила следующий вид:
1/λ = R (1/n2 – 1/m2) (35.9)
Дальнейшие опыты показали, что если m и n — целые числа и m больше n, то формула (35.9) дает длины волн всех обнаруженных на опыте линий спектра атомарного водорода. При n=1 получаются линии, лежащие в ультрафиолетовой части спектра, составляющие так называемую серию Лайман, а при n=3 – линии в инфракрасной части спектра, составляющее серию Пашена.
Подобные закономерности в расположении спектральных линий, хотя и более сложного характера, чем для атома водорода, были установлены и для других атомов. Эти экспериментальные результаты не удалось объяснить с помощью классической физики. Ядерная модель атома Резерфорда не позволяла объяснить в рамках классической физики не только спектральные закономерности, но и вообще существование спектральных линий, т. е. строго определенных длин волн излучения и поглощения атомов. Нельзя было объяснить и устойчивость самого атома.
Действительно, электрон, двигаясь вокруг ядра с центростремительным ускорением под действием силы притяжения к ядру, должен, как и всякий движущийся с ускорением заряд, непрерывно излучать электромагнитные волны, теряя энергию. Частота излучения электрона при этом должна непрерывно меняться, а сам он должен с каждым оборотом приближаться к ядру и в конце концов упасть на ядро, чего в действительности не происходит.
Чтобы объяснить эти противоречия между опытами и классической физикой, пришлось признать ограниченность применения законов классической физики к атомам. Первым этот важнейший и смелый шаг сделал один из выдающихся физиков XX в., датский ученый Н. Бор, который ввел идеи квантовой теории в ядерную модель атома Резерфорда и в 1913 г. разработал теорию атома водорода, подтвердившуюся всеми известными тогда опытами.
По идее Бора энергия атома не может иметь произвольного значения. Для каждого атома имеется ряд строго определенных, как говорят, дискретных значений энергии, которыми он может обладать. Никаких промежуточных значений энергии между этими дозволенными у атома никогда не может быть. Эти «дозволенные» природой значения энергии называются энергетическими уровнями атома. Отсюда следует, что из бесконечного множества возможных по классической физике орбит электрона в атоме допустимы только те, которые соответствуют одному из энергетических уровней атома. Такой «отбор» дозволенных орбит электрона получил название квантования орбит. В основе теории Бора лежат три постулата.
- Электроны могут двигаться вокруг ядра атома только по строго определенным орбитам, соответствующим одному из энергетических уровней атома.
- Когда электрон движется по одной из разрешенных орбит, атом находится в устойчивом состоянии, т. е. не излучает и не поглощает энергию.
- Когда электрон перескакивает с одной из дозволенных орбит на другую, более близкую к ядру, атом испускает квант энергии (фотон) в виде излучения, частота которого определяется формулой Планка (28.1).
Таким образом, Бор не отказался от применения законов классической физики к атому, а лишь наложил на них ограничения, заключающиеся в квантовании орбит и трактовке устойчивости атома. Из постулатов Бора следует, что величина кванта, испускаемого атомом при переходе из одного устойчивого состояния в другое, равна разности значений энергии атома в этих двух состояниях, т. е.
hv = Em – En, или v = Em/h – En/h
что можно записать и так:
1/λ = R (Em – En) (35.10)
Бор рассчитал радиусы дозволенных орбит электрона в атоме водорода и вычислил соответствующие им энергетические уровни. Дозволенные значения энергии атома оказались обратно пропорциональны квадратам целых чисел натурального ряда, т. е. 1, 4, 9, 16 и т. д. В результате из формулы (35.10) была получена формула (35.9), а для постоянной Ридберга получилось выражение:
R = e4m/8h3cɛ20 (35.11)
где m — масса электрона, а e заряд электрона. Теоретическое значение R, вычисленное по формуле (35.11), оказалось прекрасно совпадающим с экспериментальным значением, полученным из спектроскопических измерений.
Таким образом, теория Бора с удивительной точностью объяснила весь спектр атома водорода. Хотя применение теории Бора к более сложным атомам других элементов не дало таких блестящих количественных результатов, она позволила понять природу атомных спектров и объяснить в общих чертах законы, которым они подчиняются. Работы Н. Бора не только вывели физику из тупика, но и наметили пути быстрого развития новой науки — атомной физики.
Впоследствии была создана квантовая механика, включившая в себя теорию Бора как частный случай; постулаты Бора естественным путем получаются из уравнений квантовой механики.